
邮箱 :news@@cgcvc.com
文章来源: 发布日期:2022-08-18
优秀的企业长什么样,成功的牛人都有哪些特质?在他们的奋斗路上,有哪些需要注意的“坑”,最重要的改变是什么?
创·问 向一些优秀的华创派、投资人、业界牛人抛出问题,也希望分享他们的想法给你。本期主角是应世生物联合创始人、COO 曹飞。
应世生物聚焦突破和引领缺乏有效治疗方案的实体瘤耐药和转移治疗的创新药研发,其研发进度最快的创新药项目FAK(黏着斑激酶)小分子抑制剂IN10018,目前正在中美两地同步推进针对多个癌种、采用不同联合用药方案的临床试验,并分别于2021年8月和2022年4月获得了美国食品药品监督管理局(FDA)的快速通道认证(Fast-track Designation)和中国国家药监局(NMPA)突破性治疗药物认定。
成立3年多来,应世生物先后获得多家知名投资机构累计超过1亿美元股权投资,尤其在今年创新药资本寒冬的环境中,应世生物逆市完成两轮融资共计6500万美元融资。 公司近期还在计划启动新一轮融资。
肿瘤已经严重威胁到了患者的生命健康,成为全球第二大死因。随着人口老龄化和癌症发病率的增加,新型靶向药物、肿瘤免疫等新治疗方法的研发成功,肿瘤治疗方法不断变化,肿瘤药物市场持续增长。弗若斯特沙利文预测,2030年全球肿瘤药物市场规模约为3913亿美元左右,占总药物市场的18.8%。
在抗肿瘤斗争中,抗癌药物是重要武器。同时,耐药性也伴随着癌症治疗的不断发展,成为最大挑战之一。耐药性几乎存在于所有类型的癌症和所有抗癌药物中,包括免疫治疗、靶向治疗和化疗等。近年来,肿瘤免疫治疗领域发展迅速,PD-1/PD-L1 抗体是其中最为耀眼的新星,目前我国获批上市的 PD-1/PD-L1 抗体药物多达11款,竞争激烈。尽管如此,PD-1/PD-L1 抗体耐药却仍然没有太好的应对手段。
大多数国内创新药公司的研发往往聚焦特定药物分子——小分子、大分子或者其他类型。应世生物则不然,公司研发聚焦的是创新药更本质的需求——疾病。 公司更希望通过转化医学等研究手段,探索肿瘤耐药背后疾病生物学机制,然后选择最合适的药物来“对症下药”。公司并不局限于只做小分子或者单抗,而是像七巧板一样,谁能针对疾病机制解决实际临床中的问题,就按照自己的思路把它加入到产品的矩阵里。
应世当前最核心的管线是 FAK 小分子抑制剂 IN10018,主要瞄准针对各类型肿瘤耐药的联合用药治疗,已经证明在包括化疗、靶向治疗、免疫治疗、放疗等诸多现有的肿瘤治疗方案中,都能带来显著协同和获益。
最初绝大多数人并不认为 FAK 靶点是个有大机会的靶点,但应世基于自身对肿瘤耐药机制的深入研究,确信这个靶点具有潜在价值和差异化机会,几年前就开始布局深耕。事实也证明了公司前瞻的判断,今年以来,公司开始在多个在研适应症陆续收获漂亮的临床数据。不仅如此,在整个新药研发领域,FAK 靶点的热度也在快速升温。
本文中,曹飞分享了应世生物的破局之路:坚持以“Research”的态度做研发与临床,坚守“不内卷+全球化”的研发和竞争策略。在“资本寒冬”里,应世生物的价值反而凸显出来,“现在讲故事不能再支撑泡沫,大家会更关注业务、临床数据、技术的差异化等核心能力。在这些方面,无论是现阶段已有进展,还是未来预期目标的达成,我们都是很有信心能够呈现给大家的。”
全文分享如下:
Q:华创资本
曹飞:应世生物联合创始人、COO
Q1:请用科普的语言介绍下应世生物在做的事情。有哪些独特的创新?
曹飞: 应世生物从成立之初,就瞄准肿瘤耐药,希望解决这个目前公认的肿瘤治疗痛点。我们希望在对耐药的生物学机制有清晰了解后,针对目标人群,研发新的工具来延长患者的生命,提供治愈的可能。全球范围内看,肿瘤耐药的目标患者人群非常大,而且现阶段始终缺乏有效的治疗手段。患者、临床医生甚至监管机构,都非常希望工业界能够带来更多治疗选择。
什么叫做肿瘤耐药?近年来炙手可热的 PD-1 抗体, (编者注:PD-1抗体是近10年最重磅的抗肿瘤药物,2018年诺贝尔生理学/医学奖颁给了 PD-1靶点的发现者。) 2021年仅默沙东一家销售额就超过180亿美元。 很多人知道 PD-1抗体,却不知道即使是这么好的肿瘤药,只在不到三分之一的肿瘤患者能够起效,超过三分之二的患者并不能从中获益。
最初 PD-1抗体还没上市,刚在临床试验中展示出优异的治疗效果时,许多中国公司已经开始跟进,研发自己的 PD-1抗体。在默沙东和 BMS 的 PD-1 抗体获批两三年后,多家中国公司的 PD-1抗体也陆续上市。尽管如此,多年来临床数据表明,PD-1抗体依然只能在30%左右的肿瘤病人中获得应答,70%的病人基本是没有应答的,造成了“沉默的大多数”,这就是原发性肿瘤耐药。
为什么70%的人没有应答?这是应世团队一直想解决的问题。 国内创新药过往Fast Follow PD-1抗体的策略,或许有希望在之前那30%病人中获得更好应答,但解决不了70%患者的痛点。
另外一种情况是病人用药一段时间后,肿瘤得到了控制,但过段时间药又没有效果了。以卵巢癌为例,它是比较凶险的癌种,基于现有的诊断方法,差不多70%的病人一旦发现得病就是晚期。目前最好的治疗药物是铂类药物,初次用药在100人中大概有85%的人有应答,15%左右完全没有反应。考虑到安全性,如果肿瘤得到抑制,通常会停药。过了几个月之后,这个时候再用铂类药物,原来有应答的85个人,能够再次应答的人数开始减少。在多次用药之后,大部分人都会陆续铂耐药,这属于获得性耐药。在其它肿瘤药物的治疗中,也基本都会出现这样的耐药现象。
应世感兴趣的就是解决肿瘤耐药的问题,尤其是 PD-1抗体这样重磅品种耐药的问题,让沉默的大多数能够从现有的肿瘤药物中获益。 要解决这个问题,就不能只是跟随欧美公司探明的路线,而是需要从肿瘤生物学机制源头开始研究,在无人区探索,真正找到解决问题的答案。 我们比较幸运,几年探索下来,发现我们目前开发的 FAK 这个靶点,在各种类型肿瘤耐药,包括化疗、靶向治疗、放疗、免疫治疗这些耐药过程中都起到了关键枢纽作用。
现在大家也越来越意识到单药解决肿瘤复杂问题的局限性,尤其是肿瘤耐药更是如此,联合用药开始成为越来越主流的选择。 如果类比,FAK 抑制剂在联合用药中,就像是 co-anchor,在这个 anchor 之上,像调和鸡尾酒一样加入其它的成分,让沉默的大多数能够从现有的肿瘤药物中获益。
过去总说中国做新药没有创新,为什么呢?因为大家没有对于疾病机制的理解,缺乏足够真正对未知难题的探索。之前的做法通常是国外团队已经找到某个靶点,国内拿回来做一模一样的东西,顺着一样的思路,验证的实验设计照抄国外,包括老鼠的模型、临床试验的设计、癌种选择和阶段划分,都是照抄。有时候是 Me-too,但有时是 Me-worse。
但是现在,Low Hanging Fruit 已经摘得差不多了。按照国外同行的方法来做,看着是相对低的研发风险,但竞争一定非常激烈,不管是仿制药、首仿、Fast Follow,都会很快卷起来。这其实阻碍了大家做药物研发的前瞻性眼光,很容易忽略当下以及未来几年迫切的临床需求。
Q2:应世生物目前在研发的重点产品管线有哪些?研发进度如何?
曹飞: 目前,我们最关键的管线是 IN10018,一种高效和高选择性的黏着斑激酶(Focal Adhesion Kinase,FAK)抑制剂,主要瞄准各类型肿瘤耐药的难题。从学术界到工业界,近年来都越来越重视这个靶点在各类型肿瘤耐药的相关机制中起到的作用,其中包括我们南京研发中心的许多重要工作。用流行的说法,这个靶点的“热搜程度”在快速提升。对应世而言,比较自豪的是,我们对这个靶点,不管是机制理解还是临床进度,基本可以说都是走在全球最前沿。
应世正在开发 IN10018 用于包括铂耐药卵巢癌、黑色素瘤、三阴乳腺癌、头颈部肿瘤、胰腺癌等多种缺乏有效治疗方案的实体瘤适应症,其中一些已经获得明确的临床验证。
具体来讲,目前在进行的首个重点适应症--铂耐药卵巢癌,这几乎是大部分卵巢癌患者最后都会面对的痛点。 我们通过 IN10018 和传统化疗药物联用,目前已经完成的 Ib/II 临床数据显示,在过往标准化疗药物基础上联用 IN10018,能够将整体反应率 ORR 从不到20%提升到接近60%,无进展生存期PFS 目前也达到过往文献报道从未达到的时间长度。这个数据在今年美国最权威的肿瘤会议 ASCO 上已经公布,并且在2021年8月拿到 FDA(美国食品药品监督管理局)的 Fast-Track,2022年4月获得 NMPA(中国国家药监局)“突破性治疗药物认定”。 (注:快速通道资格为美国FDA加速药品研发和审评的重要审评程序,它们主要适用于治疗严重或危及生命的疾病的创新药物。获得这些资格不仅意味着FDA对这些创新药治疗潜力的认可,也意味着医药公司可以和FDA有更多的沟通交流机会,加快整个研发进程。NMPA“突破性治疗药物认定” 旨在帮助企业与相关机构紧密合作,加速创新疗法的研发与审批,满足亟待解决的医学需求。)
按照目前进度,铂耐药卵巢癌作为我们进度最快的适应症,预计在今年下半年启动以上市为目标的关键性临床(pivotal trial),近期预计就开始有病人入组,按照计划可能在2023年底前完成这项临床后,就可以提交上市申请。
除此之外,IN10018 还有更多不同组合的临床适应症在研和准备启动,应世的第二和第三个项目,也会在今年3季度提交临床申请。总体而言,到今年年底,应世的临床管线和布局会更加丰富。
我们的理念不是聚焦药物分子,而是聚焦疾病机制,重点就是肿瘤耐药的发病机制。我们更希望探寻清楚关注的肿瘤耐药背后致病机制,然后选择最合适的药物来“对症下药”。所以我们的产品思路不是局限于只做小分子或者单抗,而是像七巧板一样,谁能解决实际临床中的问题,我们就按照自己的思路把它加入到产品的矩阵里。
Q3:肿瘤微环境是应世关注的领域之一,在该领域的研究应世的主要关注点在哪里?
曹飞: “肿瘤微环境”这个概念提出得比较早,其构成的维度非常复杂,但就像分子和细胞的复杂度是完全不同的,二十年前谈的肿瘤微环境和今天差距也很大。
肿瘤耐药的一种表现是纤维化,可以理解为纤维细胞把肿瘤细胞包裹起来,外面的免疫细胞、药物都进不去,这在胰腺癌、弥漫性胃癌、肝癌等难治实体瘤中非常明显。 这种状况一方面会形成物理屏障,使治疗药物难以接近肿瘤,另一方面还会形成免疫耐受的微环境,使免疫治疗失去效果。
为什么很多针对这些肿瘤的药物,在体外杀伤肿瘤细胞有效,在许多小鼠模型也有效,到了人体却无效?细胞模型完全没有这种微环境造成的屏障,药物能直接作用于肿瘤细胞。绝大多数小鼠模型也是移植细胞系形成肿瘤,只有单一类型细胞形成肿瘤块,结构简单,缺乏这种复杂的微环境,药物能够较好产生效果。但多数真实世界的肿瘤患者体内由于肿瘤微环境的存在,肿瘤组织远比这个复杂的多。
直接的挑战就是,在实验室的环境中盯着肿瘤癌细胞和正常细胞的差别,找靶点来做研发是可以的,因为细胞模型没有微环境造成的屏障,药物能够直接作用于肿瘤细胞。但是,回到人体内的环境中,肿瘤患者体内的肿瘤组织和肿瘤微环境要复杂的多,这种“物理屏障”使治疗药物难以接近肿瘤,伴随形成的免疫耐受的微环境,使免疫治疗更容易失去效果。
应世研发布局的重要策略之一就是希望能从打破肿瘤微环境出发,先把门踹开,结合一系列后续策略,让更多肿瘤耐药患者也能对药物产生应答,更大程度杀伤肿瘤细胞,甚至最终努力实现治愈。
Q4:目前,应世生物管线覆盖的适应症有哪些?公司在适应症的选择上有什么策略?这些适应症对应的市场机会有多大?竞品都有哪些?应世的竞争策略是什么?
曹飞: 应世生物主要瞄准缺乏有效方案的耐药实体瘤治疗,重点关注包括铂耐药卵巢癌、弥漫型胃癌、三阴乳腺癌、胰腺癌等。以卵巢癌为例,90%~95%为卵巢原发性的癌,另外5%~10%为其它部位原发的癌转移到卵巢,70%的患者发现就是晚期,死亡率在妇科恶性肿瘤中居首位。中国每年的发病人数在6万人左右,死亡病例达接近3万人。
应世生物的研发策略和竞争策略,简单来说就是“不内卷+全球化”。 首先,立项时我们就会避免拥挤的赛道,不去参与同质化的竞争。以 FAK 靶点来说,最初绝大多数人不认为 FAK 是个有大机会的靶点,但是我们基于自己差异化的认知,做了很多前沿的探索,判断它是机会,也把它做成了有价值的赛道。
国内新药研发布局其实非常不平衡,过去惯用的 Fast Follow 等策略,只用简单跟随国外路径,核心打法是“拼速度”、“赛道前三”,如今已被证明肯定会卷入拥挤的竞争。真正First In Class的创新靶点,需要从疾病生物学机制研究入手研究,挑战虽然较大,却不会存在太多内卷竞争,而且临床入组、监管要求乃至后续商业化门槛,往往要宽松得多。未来进入欧美市场,遇到红海竞争的可能性更低,国际合作的机会也更多。
从全球来看,对于 FAK 靶点的研究,真正在临床研发阶段的只有两家公司,包括应世生物和另一家美国公司。应世生物的FAK抑制剂进度更快,最近就要启动以上市为目标的关键性临床(pivotal trial)。
有意思的是,今年以来,因为越来越多的新发现在凸显 FAK 靶点的价值,从专业生物医药文献搜索引擎 PubMed 搜索 Review 文章热度变化就可见一斑。FAK 最早在2010年前后,备受 MNC 关注,Review 数量快速上升;2015年,几家 Phase I 数据低于预期,此后连续3年 Review 数量大幅减少;2019年之后,学术界和工业界,也包括应世,对这个靶点又有一系列重要发现,尤其是几项非常积极的临床数据披露,FAK 靶点热度又重新回升。 很多公司开始重新对FAK感兴趣,但我们已经进入到二期临床的阶段,进度优势至少是五六年的差距,临床数据更是已经展现出前所未有的优势,这些都是我们的护城河。
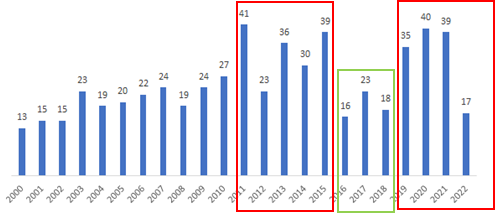
PubMed 历年搜索 FAK 综述论文数量(截至2022年5月)
开发 FAK 这种真正创新性的靶点是需要勇气的。当然,我们并不是盲目冒险,而是更多是建立在对目标疾病和 FAK 靶点相关生物学机制的深入研究和理解的基础上,当然也包括我们自身的研究实力。 我们在南京建立了研发与转化医学中心,通过最贴近目标疾病状态的各种模型和样本,探寻实体瘤大病种的耐药机制与解决方案。其中,针对 IN10018 和 FAK 靶点,我们做了大量原创探索性研究,并已经陆续在高水平学术期刊发表研究成果。
这和过去近10年中国内大多数创新药公司 Fast Follow 的策略是完全不一样的,是真正开发 First In Class 的做法。借用最近一位行业大咖在会议上的观点:中国的创新药公司,你盯着的是药,还是病?如果盯着药,你只能做 Fast Follow,只有盯着病,你才能做 First In Class。
随着临床验证逐步展开,我们越来越确信 FAK 作为有望解决多种机制肿瘤耐药的关键枢纽。对于某些癌种,目前可能并没有现成的靶点。但通过疾病生物学机制方面的研究,我们看到 FAK 和某些新靶点联用将会有很大的机会,应世后续的管线立项就是针对这些新靶点设计的创新药物。
所以,相比于其它很多公司孤立的管线布局,应世的管线布局是环环相扣的。而且推进的几个适应症,都没有成熟的解决方案或者获批的产品,对于创新药物的需求是非常迫切的,可以说应世这些项目未来机会都是非常明确的。
Q5:2020年,华创领投了应世生物的 A+ 轮融资。近两年来,行业和应世生物发生了哪些变化?
曹飞: 2020年初,整个医药行业,不管是一级还是二级市场,融资都很火。从去年下半年开始,市场几乎进入了冰封状态。二级市场医药股的下跌原因很多,主要还是资金进来的太快,严重超过了行业价值的提升速度。在资金丰富的时候,一级市场的估值已经被抬得很高了。所以下跌之后,一级市场的投资人和创业公司都开始担心退出的路径和机会。
对于应世生物来说,虽然有压力,但是我们的价值反而凸显出来,因为现在讲故事不能再支撑泡沫,大家会更关注业务、临床数据、技术等核心能力,关注那些不内卷、真正差异化的创新方向。在这些方面,无论是现阶段已有进展,还是未来预期目标,我们都是很有信心能够拿得出手的。
作为身处一线的公司,我们最直观的感受就是行业到了“洗去浮华、去伪存真”的时候。 整个行业需要真正的创新力,把不内卷的产品在全球范围内做出非常好的数据和疗效。虽然这两年大环境经历了过山车一样的变化,但是应世生物自始至终坚定在小步快走。
这两年应世的变化主要体现在三方面。第一,管线研发上,IN10018 抑制剂多个临床适应症稳步推进,我们已经拿到了非常扎实的临床数据,也拿到了刚才提到的 FDA Fast Track 和 NMPA 突破性疗法的资质。第二,有两个新的品种会进入到临床开发的阶段,管线更加丰富。同期,我们在南京建立了研发和转化医学的开发中心,整个实验室的团队建立起来,拥有创新药从上游药物发现到下游临床开发的全链条研发能力。按照我们的立项思路,南京的研发中心在做一些新的大分子、小分子的前沿项目,在机制研究上有了更强的投入。第三,这一年多时间我们又完成了两轮融资,公司的价值得到了肯定,拥有不错的现金储备,现在各方面业务都非常健康,团队也更加完整。
Q6:应世生物的创始人团队具有行业领先企业工作的经历。如何不断地吸引高质量人才?
曹飞: 首先,优秀的人才加入一家公司,肯定是看中这份事业的前景,认可公司在做的事情,期待参与其中实现内心的期许,能够在整个产业和欧美公司同台竞技的时代机遇中,发挥自己的才智与能力。
第二,公司的文化很重要。在创业团队里,扁平化、透明化的团队文化,能够让每个人都有 ownership,主动地承担责任。现在我们公司有近六十人,有任何问题,我可以拿起电话打给一线任何一名员工。我们内部有定期的沟通机制,公开地和所有人分享公司重要的进展以及面临的挑战,大家能够集思广益。我们希望每位应世生物的员工,在有一天公司发展到几百、上千人时,能够说公司早期阶段的一切喜悦、痛苦,大家都一起经历过。
第三,当然,初创公司想要持续不断地吸引人才,一定不能只开空头支票,需要把好产品和好临床数据不断地做出来,通过自己的 track record,证明自己是值得托付的团队。
Q7:应世生物作为一家 Biotech Start-up,与在国际大型公司相比,有哪些独特的优势?面对的主要挑战有哪些?
曹飞: 应世生物一直坚持以“Research”的态度来做研发与临床。 在研发上,我们在立项时会避免进入拥挤的赛道,通过差异化的药物开发策略来选择突破口,决策速度非常快。如果出现问题,我们也可以及时停止,船小好掉头。从这个层面讲,我们创新的模式更轻巧灵活,效率也更高。
第二,刚刚提到了我们的企业文化,大家都是一心想要干成这件事,不存在大公司体制的限制或内耗。作为一家年轻有活力的 Biotech 公司,大家参与感很强,能够互相激发新的创意和想法。现在很多大公司创新力枯竭,都希望通过收购或者合作的方式,和我们这样的小团队合作。
面对的挑战,主要是资本实力没法和大公司相比,在管线有限的情况下,单个项目的失败可能会是比较大的打击。 为了应对挑战,我们一直掌握着比较好的融资节奏,同时开源节流,资本效率非常高,花很少的钱,干了很多事。
另外,我们瞄准了“别人看不到的机会”,敢于去钻研和投入,这也是能够获得大家能获得丰厚回报的原因之一。
Q8:王在琪博士(应世生物创始人、董事长)在某次采访中提到,中国创新药的生态已经有了很大的进步,化合物的机会已经储备了非常多。但是,如何把临床转化这个关键环节做好是个大问题。应世生物在临床转化的环节做了哪些探索?
曹飞: 首先,我们通过 in-house 研究,对相关靶点从细胞到个体不同层面的疾病模型中开展生物学机制进行探索。机制研究对于药物的有效性和安全性极其重要,尤其是进入临床开发后。 如果一款药在临床过程出现风险,我们可以根据对疾病机制的理解,采取相应对策,实现更好的安全性。如果发现有效,我们也可以根据机制,进一步设计验证,更大程度提升有效性。在 IN10018 的开发中,针对不同癌种的联用策略背后,是疾病生物学机制研究方案有针对性的设计,以及模型验证在细节上的打磨。
其次,针对创新靶点的药物开发,从方案设计、临床运营等各个环节,细微的差别对最终的结果都会有巨大影响。对于药物研发过程细节的把握,背后需要扎实的临床研究能力,包括创始人对临床研究的判断、临床团队的经验与规范、临床前研究的协同等。 举个例子,IN10018 针对胃癌的临床项目早期,我们发现胃癌患者很难入组。通过和医生的探讨,我们发现胃癌患者容易发生腹膜转移、腹水,而腹膜转移跟微环境和某种免疫细胞有关系。于是我们就从这个角度出发,从产品池里找到与该机制相关的产品,作为后续探索方向。
与此同时,我们在中美两地选择不同的癌种,设计对应的临床方案,也是希望瞄准实际的临床需求和条件,通过“对症下药”来获得更高的成功率。
Q9:经过两年时间,应世生物建立了怎样的合作网络?主要的合作方式有哪些?
曹飞: 我们一方面和许多科研院所开展诸多合作,主要是对我们感兴趣的疾病和靶点机制相关的转化医学研究,跟包括国外的哈佛大学医学院、约翰霍普金斯医学院、UCSD、耶鲁大学以及国内的上海交大医学院、北医等机构都有合作研发,并且都有高水平研究论文发表。
另一方面我们和许多药企,包括罗氏、默沙东、益方、康宁杰瑞等,都有不同适应症和联用组合的 co-development 合作。我们之所以能够和这些国际大药企以及国内的许多 Biotech 公司建立合作伙伴关系,主要是基于彼此间差异化互补和管线的协同,以及大家对相应联用组合在目标适应症成功机会的认可。
下一步我们主要的任务是 IN10018 海外权益的 License Out,目的是进一步推动已在中美同步临床开发的 IN10018 的后续国际化进程。
Q10:2022年伊始,“信达生物ODAC被拒、PD-1出海受挫”给国内创新药出海浇了一盆冷水,这对中国创新药未来的研发和国际化有何影响?产品开发和注册战略上,有何启示?
曹飞: 国内创新药想要做国际市场,尤其是美国市场,在立项之初的全盘设计就要符合国际化的标准,包括适应症的选择、设计临床试验、筛选患者入排标准、医学监察、数据整理、解读临床数据、撰写临床研究报告、与监管部门沟通等各个环节等每个环节。 整套方案真正的“国际化”需要对目标市场的监管规则和医学实践有丰富的经验和深刻的理解。按照这样的标准,目前有能力出海的创新药企并不多。
国际化不能投机,如果抱着把国内研发的路径和结果直接到欧美国家简单 copy & past的心态,这样的国际化基本是走不通的。
Q11:应世生物为何从一开始就选择中美双报策略?创业即定位国际化公司的打法,对公司运营、申报策略等各方面提出了更高的要求,应世生物做了哪些针对性的规划?
曹飞: 中国创新药公司下一阶段的发展,一定是走出国门,真正面对国际化发展。研发国际化,尤其是面向欧美市场开发新药,将同时面临发达国家监管机构的审评标准和相应企业的市场竞争,这对中国公司能力的锻造是最好的试金石。挑战非常大,但真金不怕火炼,最终杀出来的都是真正的佼佼者。
应世生物团队本身有丰富的国际化研发和运营的经验,在国外临床研究协作的网络中,有自己的影响力,例如我们与哈佛医学院、MD Anderson Center等机构的教授有长期的合作协议。
过程里团队和专家们有很多碰撞,团队也在快速成长,能够更自如地应对国际化的项目和挑战。
Q12:今年,应世生物陆续完成B轮、B+轮融资,融资所募资金将主要投入到哪些方面?后续有何融资计划?
曹飞: 首先,现有临床管线会快速,包括 IN10018 即将启动的以上市为目的的关键性临床(pivotal trial)和其他针对多个适应症的各类型联用组合,以及近期提交临床申请的两个全球创新药的临床试验推进;第二,在早期的研发和转化医学项目的创新性研究上,会更多的投入,快速地推动临床的转化;第三,在整个公司运营层面,招募更多的人才,推动各项业务的发展。
近期,我们正在准备启动新一轮融资。
